KVALITAN - virtuálne chemické lagoratóriumŽelezo / Dôkazy / Katióny III. triedy / Katióny / Teória
Dôkazy železa
Dimetylglyoxím
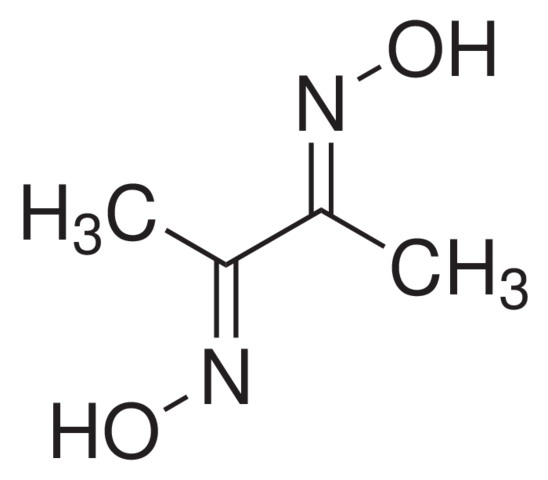
Jednopercentný alkoholický roztok dimetylglyoxímu s roztokmi dvojmocného železa poskytuje intenzívne červené sfarbenie. Táto reakcia sa dá výhodne použiť pri určovaní solí železnatých. K roztoku skúmanej látky pridáme najprv kyselinu vínnu, ktorá vytvorí s trojmocným železom komplexnú zlúčeninu, nezrážajúcu sa amoniakom. Nato pridáme amoniak a jednopercentný alkoholický roztok dimetylglyoxímu.
α, α′-dipyridyl
Dvojpercentný roztok α, α′-dipyridylu v HCl poskytuje s roztokmi solí železnatých tmavočervenú zlúčeninu pD = 6,2.
Chinaldínová kyselina
poskytuje s roztokmi solí železnatých červeno sfarbené roztoky, ktoré po pridaní KSCN získajú na intenzite. Soli železité sa musia najprv zredukovať, na čo je najvýhodnejšie použiť hydroxylamín-hydrochlorid. Metódu možno použiť aj na kolorimetrické stanovenie železa, pričom prítomnosť Cu, Ni, Co a Zn nie je prekážkou.
Izonitrozoacetofenón
poskytuje s roztokmi solí železnatých modrú zlúčeninu.
Oxidačné činidla
Účinkom oxidačných činidiel, ako kyseliny dusičnej, brómovej vody, chlóru a peroxidu vodíka, chrómanov a manganistanu draselného oxidujú sa v kyslom prostredí zlúčeniny železnaté na železité, čo je sprevádzané zmenou farby roztokov z bledozelena do žltozelena:
6 FeCl2 + 2 HCl + 2 HNO3 ⇔ 6 FeCl3 + 4 H2O + 2 NO
6 FeSO4 + 3 Cl2 ⇔ 2 Fe2 (SO4)3 + 2 FeCl3
10 FeSO4 + 2 KMnO4 + 8 H2SO4 ⇔ 5 Fe2 (SO4)3 + K2SO4 + 2 MnSO4 + 8 H2O
Izonitrozodibenzoylmetán
dáva v slabo kyslom prostredí za prítomnosti tlmivých roztokov modrú, prípadne modrozelenú zlúčeninu. Ako činidlo sa používa 1% alkoholický roztok. Po pridaní činidla sa papierik vystaví účinkom dymov amoniaku alebo sa reakcia upraví octanom sodným.
Trojmocné železo sa zredukuje tiosíranom za tepla. Meď sa blokuje jodidom draselným za prítomnosti kyseliny siričitej. Ak treba určovať dvojmocné železo za prítomnosti trojmocného, trojmocné železo blokujeme fluoridom sodným. Soli nikelnaté a kobaltnaté rušia dôkaz železa a dôkaz znecitlivejú soli Zn, Pb, Mn, Cr3+ a Ag.
Ak máme dostatok skúmanej látky, možno postupovať aj takto: Do skúmavky dáme 5 ml činidla, 2,5 ml 10% roztoku octanu sodného a toľko skúmaného roztoku, aby sa činidlo nevylúčilo. Asi o minútu pridáme 2 ml benzénu a obsah skúmavky pretrepeme. Ak je železo prítomné, benzénová vrstva sa sfarbí na modro.
Bromoxín
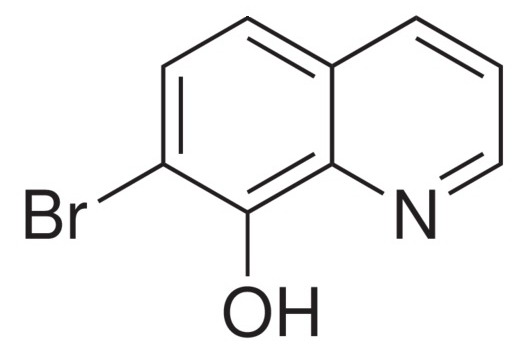
poskytuje s roztokmi solí železitých zelenočiernu zrazeninu. Táto reakcia je veľmi citlivá a na jej základe možno železo dokázať temer vedľa všetkých katiónov.
Redukovadlá
ako kyselina siričitá, chlorid cínatý, vodík v stave zrodu, jodid draselný atď., redukujú soli železité na železnaté:
2 FeCl3 + Zn + 2 HCl ⇔ 2 FeCl2 + ZnCl2 + 2 HCl
2 FeCl3 + SnCl2 ⇔ 2 FeCl2 + SnCl4
2 FeCl3 + SO2 + H2O ⇔ 2 FeCl2 + H2SO4 + 2 HCl
2 FeCl3 + 2 Na2S2O3 ⇔ 2 FeCl2 + Na2S4O6 + 2 NaCl
2 FeCl3 + 2 KI ⇔ 2 FeCl2 + I2 + 2 KCl
2 FeCl3 + H2S ⇔ 2 FeCl2 + S + 2 HCl
Kupferon
vylučuje z roztokov solí železitých okyslených HCl, kyselinou sírovou alebo octovou červenohnedú vločkovitú zrazeninu.
α, α′-dipyridyl
Na dno téglika dáme kvapku skúmaného roztoku a kryštálik hydroxylamínhydrochloridu (na zredukovanie železa). Potom pridáme kvapku činidla a kvapku amoniaku na zalkalizovanie reakčného prostredia. Za prítomnosti železa vznikne ružové až červené sfarbenie podľa množstva prítomného železa. Ak sú v skúmanom roztoku oxidovadlá, pridáme toľko hydroxylamínu, koľko treba na zredukovanie železa, lebo železo pri tejto skúške musí byť dvojmocné. Potrebné roztoky: 4 mo l-1 amoniak, tuhý hydroxylamín, 0,2% roztok dipyridylu v 3 mo l-1 HCl.
o-fenantrolín
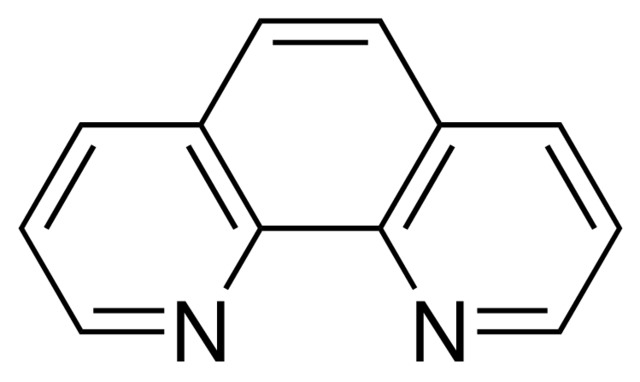
Na dno téglika dáme kvapku kyslého skúmaného roztoku, potom niekoľko kryštálikov -hydroxylamínu na zredukovanie železa a kvapku činidla. Za prítomnosti železa vznikne červené sfarbenie. Potrebné činidlá: Tuhý hydroxylamín a 0,025 mol l-1 vodný roztok o-fenantrolínu.
Dimetylglyoxím

Na dno téglika dáme kvapku skúmaného roztoku a toľko hydrochloridu hydroxylamínu, aby prítomné železo kvantitatívne prešlo na dvojmocné. Nato pridáme kvapku činidla a toľko amoniaku, aby reakčné prostredie bolo mierne alkalické. Za prítomnosti železa vznikne červené sfarbenie.
Kyselina sulfosalicylová
Na dno téglika dáme kvapku slabo kyslého skúmaného roztoku a toľko peroxysíranu draselného, aby prítomné železo kvantitatívne prešlo na trojmocné. Nato pridáme kvapku činidla. Ak je železo prítomné, vznikne fialové sfarbenie. Potrebné chemikálie: Peroxysíran draselný a 5% vodný roztok kyseliny sulfosalicylovej.
Pyramidón

a rodanid draselný za prítomnosti katiónu dvojmocného kobaltu. Železo musí byť prítomné ako trojmocné. Dvojmocné železo pred skúškou zoxidujeme peroxysíranom draselným.
Kvapku skúmaného roztoku dáme na podložné skielko a k nej pridáme kvapku chloridu kobaltnatého. Roztok odparíme nad mikrokahanom do sucha a po vychladnutí pridáme kvapku činidla a kvapku zriedenej HCl. Potom roztok zahrejeme a tyčinkou napomáhame kryštalizáciu. Za prítomnosti železa vzniknú ružové kryštáliky v podobe hviezdic, premiešané modrými kryštálikmi soli kobaltnatej. Nadbytok soli kobaltnatej prekáža pri kryštalizácii.
Potrebné roztoky: 0,02% roztok chloridu kobaltnatého, nasýtený roztok pyramidónu vo vode nasýtenej rodanidom amónnym, 0,3 mol l-1 HCI a peroxysíran draselný.



